검색
최근검색어
-
식약처2026-02-17검색기록 지우기
-
가족2026-02-17검색기록 지우기
-
달서구2026-02-17검색기록 지우기
-
전력난2026-02-17검색기록 지우기
-
수어2026-02-17검색기록 지우기
저장된 검색어가 없습니다.
검색어 저장 기능이 꺼져 있습니다.
검색어 저장 끄기
전체삭제
총
3,049
건




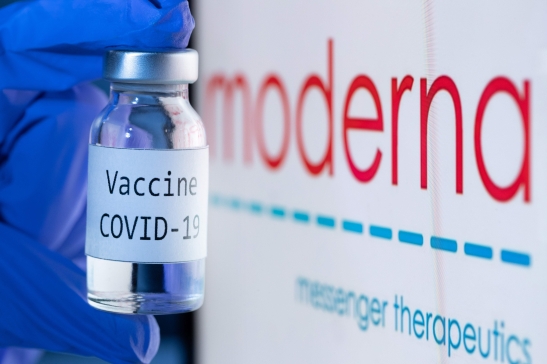

![[속보] 삼성바이오로직스, 3분기부터 모더나 백신 국내서 생산](http://img.seoul.co.kr/img/upload/2021/05/23/SSI_20210523091409_V.jpg)